 |
乽傾僋僠價儞俙偵傛傞傾僼儕僇僣儊僈僄儖泱枹暘壔嵶朎偐傜偺
丂 in vitro偱偺妠婄柺擃崪偺桿摫乿
峀搰戝妛戝妛堾帟妛尋媶壢帟妛椪彴宯乮岥峯奜壢妛戞堦乯
暉堜峃恖巵 |
戞1復丂弿尵
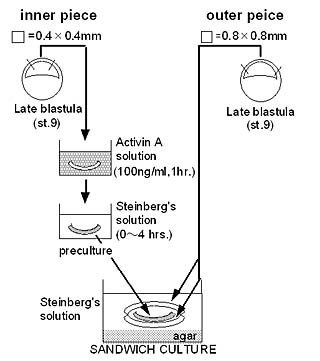
丂Xenopus偺庴惛棏偼丆棏妱傪孞傝曉偟偰孠幚泱偲屇偽傟傞僗僥乕僕偵払偡傞丏偙偺帪婜偺泱偼丆梊掕奜泱梩偵偁偨傞摦暔敿媴偲梊掕撪泱梩偵偁偨傞怉暔敿媴偐傜側傝丆梊掕撪泱梩堟偺嵶朎偼丆偦偺忋偵埵抲偡傞愒摴柺晅嬤偺懷堟偺嵶朎偵懳偟偰丆拞泱梩桿摫偲屇偽傟傞暘壔桿摫傪婲偙偡丏拞泱梩桿摫傪庴偗偨嵶朎偼丆宍惉懱乮僆乕僈僫僀僓乕乯偲側傝丆尨挵娮擖塣摦傪婲偙偟偰泱撪傊偲堏摦塣摦傪峴偆丏偝傜偵丆撪泱梩偵傛偭偰桿摫偝傟偨丆彨棃愐嶕偵暘壔偡傞嵶朎傪拞怱偲偟偨椞堟偼丆尨挵娮擖偟側偑傜昞柺傪暍偭偰偄傞梊掕奜泱梩偵懳偟偰恄宱桿摫傪婲偙偡丏偟偨偑偭偰丆拞泱梩桿摫偼扨偵拞泱梩偲偄偆慻怐偺暘壔偺偨傔偵昁梫偱偁傞偩偗偱偼側偔丆敪惗弶婜偵偍偗傞宍懺宍惉偵晄壜寚側暘巕僔僌僫儖傪敪偡傞応偺宍惉偵昁梫側僗僥僢僾偱偁傞偲峫偊傜傟偰偄傞乮恾1乯丏
丂1980擭戙偺敿偽偐傜丆fibroblast growth factor乮FGF乯傗transforming growth factor-兝乮TGF-兝乯側偳丆拞泱梩桿摫擻傪桳偡傞婔偮偐偺桿摫場巕偑摨掕偝傟偰偒偨丏1990擭偵Asashima傜偼丄崪悜惈敀寣昦嵶朎偺攟梴忋惔傛傝暘棧丆惛惢偟偨拞泱梩桿摫場巕偑丆棏朎巋寖儂儖儌儞偺暘斿懀恑場巕偲偟偰傕抦傜傟偰偄偨傾僋僠價儞A偱偁傞偙偲傪柧傜偐偵偟偨丏枹暘壔梊掕奜泱梩偵憡摉偡傞傾僯儅儖僉儍僢僾乮AC乯傪梡偄傞傾僯儅儖僉儍僢僾傾僢僙僀乮ACA乯偵偍偗傞傾僋僠價儞A偺嶌梡偼丆柧妋偵擹搙埶懚惈傪帵偟丆擹搙偑崅偔側傞偵廬偭偰傛傝攚懁偺拞泱梩傪桿摫偡傞丏0.3乣1.0
ng/ml偱偼AC偺撪晹偵偼寣媴丆懱峯忋旂丆娫廩怐偑丆5乣10ng/ml偱偼嬝擏偑丆50乣100ng/ml偵偍偄偰偼丆嵟傕攚懁偺拞泱梩偱偁傞愐嶕偑暘壔偟偰偔傞丏傑偨丆枹張棟偺AC偼暘壔偣偢偵昞旂條嵶朎偺夠乮晄惍宍昞旂乯偲側傞丏偙傟傜傾僋僠價儞偵傛傝桿摫偝傟偨慻怐偼慻怐妛揑偵傕暘巕惗暔妛揑偵傕惓忢泱偱傒傜傟傞慻怐偲摨偠偱偁傞丏偝傜偵傾僋僠價儞A偺摿挜偲偟偰丆僆乕僈僫僀僓乕妶惈傪桳偡傞偙偲偑偁偘傜傟傞丏Ariizumi傜偼丆椉惗椶偺AC傪堦掕帪娫傾僋僠價儞張棟偟丆堎側偭偨帪娫AC旕懚嵼壓偱攟梴偟偨屻偵嵞傃暿偺AC擇枃偱嫴傒崬傓丆傾僯儅儖僉儍僢僾僒儞僪僀僢僠攟梴朄乮AC-SA乯傪梡偄偰丆傾僋僠價儞A張棟AC偑傾僋僠價儞A偺擹搙偲張棟帪娫偵埶懚偟偰摢晹丆摲旜晹偺僆乕僈僫僀僓乕妶惈傪桳偡傞偙偲傪柧傜偐偵偟偨丏傑偨丆ACA偵偍偄偰丆傾僋僠價儞A偺昗揑堚揱巕偺梊掕奜泱梩椞堟偵偍偗傞敪尰偺帪娫揑悇堏偼丆惓忢泱偵偍偗傞偦傟偲摨偠偱偁傞偙偲傕柧傜偐偵偝傟偰偄傞丏偙傟傜偐傜丆傾僋僠價儞A偲枹暘壔梊掕奜泱梩椞堟傪梡偄傞偙偲偵傛傝丆惓忢泱偵偍偗傞敪惗傪in
vitro偱嵞尰偡傞偙偲偑弌棃傞偲悇應偝傟傞丏
丂堦曽丆妠婄柺偺擃崪宍惉偵偍偄偰丆拞泱梩傕偟偔偼恄宱採桼棃偺枹暘壔娫梩宯嵶朎偼丆堲摢媩偵堏摦偟丆擃崪宍惉梊掕椞堟偱嬅廤夠傪宍惉偡傞丏嬅廤夠傪宍惉偟偨枹暘壔娫梩宯嵶朎偼丆嘦宆丆嘰宆僐儔乕僎儞偍傛傃傾僌儕僇儞側偳偺嵶朎奜婎幙傪嶻惗偡傞擃崪嵶朎偵暘壔偟丆嵟廔揑偵infrarostral擃崪丆儊僢働儖擃崪丆岥奧曽崪丆橐媩擃崪側偳偺惉弉擃崪慻怐傪宍惉偡傞丏
丂杮尋媶偱偼丆Xenopus泱AC-SA傪梡偄偰in vitro偵偰妠婄柺擃崪傪桿摫偡傞偙偲傪帋傒, 桿摫偟偨擃崪尨婎偵懳偟丆慻怐妛揑偍傛傃暘巕惗暔妛揑側夝愅傪峴偭偨丏
 |
恾2. 傾僯儅儖僉儍僢僾僒儞僪僀僢僠攟梴朄
丂st.9泱偺枹暘壔梊掕奜泱梩椞堟乮傾僯儅儖僉儍僢僾乯傪0.4亊0.4mm戝偱愗傝弌偟丆傾僋僠價儞A 100ng/ml傪娷傓SS拞偱1帪娫張棟偟偨屻丆傾僋僠價儞A傪娷傑側偄SS拞偱0丆1丆2丆3丆4帪娫慜攟梴偟偨丏慜攟梴帪娫廔椆屻丆暿偺st.9泱傛傝愗傝弌偟偨0.8亊0.8mm戝偺傾僋僠價儞枹張棟偺傾僯儅儖僉儍僢僾2枃傪梡偄偰嫴傒崬傒丆僒儞僪僀僢僠攟梴傪峴偭偨丏
|
戞2復丂嵽椏偍傛傃曽朄
戞1愡丂僒儞僪僀僢僠攟梴朄偵偍偗傞慻怐桿摫偺奺忦審壓偱偺専摙
丂庴惛棏偺嵦庢偼丆幚尡奐巒栺16帪娫慜偵惉弉偟偨Xenopus帗梇偵僑僫僪僩儘僺儞傪600IU旂壓拲幩偟丆帺慠岎攝偝偣偰峴偭偨丏摼傜傟偨庴惛棏偼丆pH
7.8偵挷愡偟偨4.5%L-僔僗僥僀儞墫巁墫悈榓暔傪娷傓Steinberg巵塼乮SS乯拞偱扙僛儕乕傪偟偨屻丆幒壏偱僗僥乕僕9乮st.9丆朎泱婜乯偵側傞傑偱敪惗傪恑傔偨丏AC-SA乮恾2乯偼丆恾偵帵偡曽朄偱峴偄丆
0.1% BSA傪娷傓SS偱枮偨偟偨96寠僾儗乕僩偵偰20亷偱4擔娫傕偟偔偼7擔娫攟梴偟丆10%拞惈娚徴儂儖儅儕儞塼偵偰屌掕偟偨丏側偍丆攟梴婜娫7擔偺explant偼丆4擔栚偵96寠僾儗乕僩偐傜24寠僾儗乕僩偵堏偟姺偊偰偝傜偵3擔娫攟梴偟偨丏
丂屌掕偟偨慻怐偼丆扙悈丆扙帀丆僷儔僼傿儞曪杽屻丆岤偝6兪m偺楢懕愗曅傪嶌惉偟丆PAS/傾儖僔傾儞僽儖乕廳愼怓朄傪梡偄偰愼怓偟丆慻怐桿摫偵偮偄偰専摙偟偨丏
戞2愡丂Explant偵偍偗傞擃崪偺暘壔儅乕僇乕偱偁傞嘦宆僐儔乕僎儞敪尰偺柶塽慻怐妛揑専摙
丂戞1愡偵弨偠偰丆AC傪愗傝弌偟丆傾僋僠價儞A張棟傪1帪娫峴偭偨丏懕偄偰丆慜攟梴帪娫1帪娫偺忦審偱SS拞偵偰慜攟梴屻丆枹張棟AC擇枃偱嫴傒崬傒96寠僾儗乕僩偵偰20亷偱4丆7丆10丆14擔娫丆SS拞偱攟梴偟偨丏側偍丆攟梴婜娫7丆10丆14擔孮偱偼丆攟梴4擔栚偱戞1愡摨條24寠僾儗乕僩偵堏偟姺偊偰丆寁7丆10丆14擔娫攟梴偟偨丏Explant偺屌掕偼-20亷偺椻傾僙僩儞偱峴偭偨丏扙帀屻丆僷儔僼傿儞曪杽偟丆6兪m偺楢懕愗曅傪嶌惢偟偨丏師偵楢懕愗曅傪擇偮偺僌儖乕僾偵暘偗丆堦曽偵懳偟PAS/傾儖僔傾儞僽儖乕廳愼怓傪峴偄慻怐憸傪妋擣偟偨丏懠曽偵懳偟偰丆mouse
anti-collagen type嘦峈懱傪梡偄偰柶塽慻怐愼怓傪峴偭偨丏
戞3愡丂Reverse Transcription-PCR乮RT-PCR乯朄偵傛傞奺堚揱巕敪尰偺専摙
丂RT-PCR偵愭棫偪丆摢晹丆摲旜晹偵暘妱偟偨惓忢泱丆惓忢泱慡懱偍傛傃explant偐傜total RNA偺拪弌傪峴偭偨丏師偵丆拪弌偟偨total
RNA傪DNase嘥傪梡偄偰慜張棟偟偨丏媡揮幨斀墳偼丆25亷 10暘娫丆42亷 50暘娫丆70亷 15暘娫incubate偟偰cDNA傪崌惉偟偨丏
PCR斀墳偼丆曄惈斀墳95亷 1暘丆傾僯乕儕儞僌傪Xenopus Distal-less 4乮X-dll4乯丆type嘦collagen乮Col2乯丆Xenopus
Cartilage homeoprotein 1乮Cart-1乯丆ornithine
decarboxylase乮ODC乯偱偼55亷 30昩丆goosecoid乮gsc乯偱偼61亷 1暘偺忦審偱峴偄丆怢挿斀墳72亷
30昩偲偟丆偙傟傪1 cycle偲偟偰X-dll4丆Col2丆ODC 偱偼25 cycle丆Cart-1偱偼28 cycle丆gsc
偱偼30 cycle峴偄丆PCR嶻暔傪摼偨丏
丂崱夞丆梡偄偨堚揱巕偺摿堎揑僾儔僀儅乕偼昞1偺偛偲偔愝寁偟偨丏
戞4愡丂In situ hybridization乮ISH乯偵傛傞奺堚揱巕偺嬊嵼偺専摙
侾乯cRNA僾儘乕僽偺嶌惢
丂ISH偵愭棫偪丆X-dll4丆Col2丆Cart-1偍傛傃gsc偺僾儔僗儈僪DNA傪梡偄偰cRNA僾儘乕僽傪嶌惢偟偨丏ISH偵梡偄傞惓忢泱偍傛傃explant慻怐偼丆4%僷儔儂儖儉傾儖僨僸僪偵偰4亷壓24帪娫屌掕屻丆扙悈丆扙帀丆僷儔僼傿儞曪杽屻丆10兪m偺愗曅傪嶌惢偟偨丏Col2埲奜偺僒儞僾儖偼丆扙僷儔僼傿儞屻丆傾儖僔傾儞僽儖乕偵偰愼怓偟偨丏Hybridization偼丆DIG-labeled
Col2, Cart-1, gsc cRNA probe丆fluorescein-labeled X-dll4 cRNA probe傪68亷丆16帪娫偱峴偭偨丏DIG昗幆偟偨Col2偺僔僌僫儖偼丆NBT/BCIP傪梡偄偰専弌偟偨丏傑偨丆Col2傪彍偔惓忢泱偺僒儞僾儖偼丆昗幆峈DIG峈懱丆價僆僠儞-僠儔儈僪丆傾儖僇儕僼僅僗僼傽僞乕僛昗幆僗僩儗僾僩傾價僕儞丆5%億儕價僯儖傾儖僐乕儖娷桳NBT/BCIP傪梡偄偰DIG偺僔僌僫儖傪専弌偟偨丏偝傜偵explant偱偼丆DIG偼僠儔儈僪-cyanine
3偱丆fluorescein偼丆 僠儔儈僪-fluorescein傪梡偄偰専弌偟偨丏
戞3復丂寢壥
1. 僒儞僪僀僢僠攟梴朄偵偍偗傞慻怐桿摫偺奺忦審壓偱偺専摙
丂傾僋僠價儞A 乮100ng/ml乯偱1帪娫張棟屻丆SS拞偱偺慜攟梴帪娫傪0丆1丆2丆3丆4帪娫偲偟偰AC-SA傪峴偄丆奺忦審壓偱桿摫偝傟偨慻怐傪斾妑専摙偟偨丏攟梴婜娫4擔偱偼丆慜攟梴帪娫偑挿偄傎偳僙儊儞僩態丆娽曪側偳偺慜曽摢晹慻怐偑桿摫偝傟傞孹岦偑妋擣偝傟偨乮恾3乯丏攟梴婜娫7擔偱偼丆4擔偲摨條偵丆慜攟梴帪娫偑挿偄傎偳慜曽摢晹慻怐偑桿摫偝傟傞孹岦傪擣傔偨乮恾4乯丏桿摫偝傟偨慻怐偼丆攟梴婜娫4擔偱偼丆枹暘壔娫梩宯嵶朎偺嬅廤夠偼娤嶡偝傟偨傕偺偺丆傾儖僔傾儞僽儖乕梲惈擃崪尨婎偼丆専弌偡傞偙偲偑偱偒側偐偭偨乮恾5A乯丏攟梴婜娫7擔偱偼丆傾儖僔傾儞僽儖乕梲惈偺擃崪條嵶朎傗擃崪惈慻怐偑explant撪偵桿摫偝傟偰偄偨乮恾5B乯丏偦偺桿摫棪偼丆慜攟梴帪娫偑1帪娫偺忦審偱47.8%偱偁傝丆嵟傕崅棪傪帵偟偨丏廬偭偰丆埲壓偺幚尡偵偼丆AC傪傾僋僠價儞A張棟1帪娫丆慜攟梴帪娫1帪娫偺忦審偱AC-SA峴偭偨丏
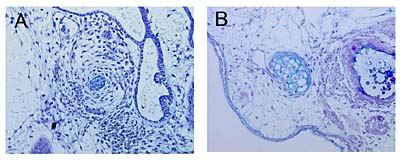 |
恾5. explant偺PAS/傾儖僔傾儞僽儖乕廳愼怓憸
(A)丗攟梴婜娫4擔偺explant偺PAS/傾儖僔傾儞僽儖乕廳愼怓憸(B)丗攟梴婜娫7擔偺explant偺PAS/傾儖僔傾儞僽儖乕廳愼怓憸
乮bar: 50兪m乯
|
2. Explant偵偍偗傞嘦宆僐儔乕僎儞敪尰偺柶塽慻怐妛揑専摙
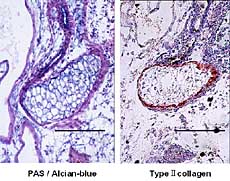
丂擃崪嵶朎偑摿堎揑偵敪尰偡傞嵶朎奜婎幙偱偁傞嘦宆僐儔乕僎儞乮Col2乯偺 丆桿摫偝傟偨擃崪尨婎偵偍偗傞敪尰傪柶塽慻怐妛揑偵専摙偟偨丏攟梴婜娫4擔偱偼丆傾儖僔傾儞僽儖乕梲惈偺娫梩宯嵶朎嬅廤夠偺拞怱晹偺嵶朎偵Col2偺敪尰傪擣傔偨乮恾6乯丏攟梴婜娫7擔偱偼丆傾儖僔傾儞僽儖乕梲惈偺枹惉弉擃崪嵶朎偵嫮偄Col2偺敪尰傪擣傔丆偝傜偵擃崪尨婎廃曈偵尒傜傟傞枹暘壔娫梩宯嵶朎偵傕Col2偺敪尰傪擣傔偨乮恾7乯丏
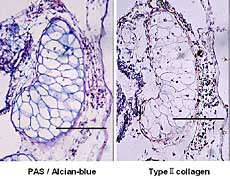
攟梴婜娫10擔偱偼丆擃崪尨婎廃埻偺擃崪枌條偺嵶朎偵Col2偺敪尰傪擣傔偨傕偺偺丆暘壔偺恑傫偩擃崪尨婎拞怱晹偺擃崪嵶朎偵偼Col2偺敪尰偼傢偢偐偱偁偭偨乮恾8乯丏攟梴婜娫14擔偱偼丆惉弉擃崪嵶朎偼梲惈傪帵偝偢丆擃崪枌條嵶朎偑傢偢偐偵梲惈斀墳傪帵偟偨乮恾9乯丏
 |
 |
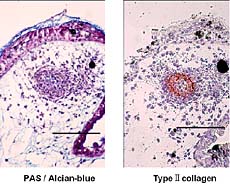
恾6. 柶塽慻怐愼怓偵傛傞攟梴婜娫4擔偺explant偵偍偗傞type嘦collagen敪尰乮bar:
50兪m乯
|
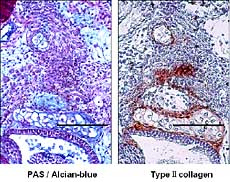
恾7. 柶塽慻怐愼怓偵傛傞攟梴婜娫7擔偺explant偵偍偗傞type嘦collagen敪尰乮bar:
50兪m乯
|
 |
 |
恾8. 柶塽慻怐愼怓偵傛傞攟梴婜娫10擔偺explant偵偍偗傞type嘦collagen敪尰乮bar:
50兪m乯
|
恾9. 柶塽慻怐愼怓偵傛傞攟梴婜娫14擔偺explant偵偍偗傞type嘦collagen敪尰乮bar:
50兪m乯
|
3. RT-PCR朄偵傛傞奺堚揱巕敪尰偺専摙
丂X-dll4丆Col2丆Cart-1丆gsc丆ODC偺explant偍傛傃惓忢泱乮摢晹丆摲旜晹丆慡懱乯偵偍偗傞敪尰傪RT-PCR朄傪梡偄偰専摙偟偨丏X-dll4
mRNA偼丆惓忢泱偱偼丆st.22-28丆st.35丆st.41偺摢晹偵尷嬊偟偨敪尰傪妋傔偨乮恾10乯丏傑偨丆explant偱偼丆攟梴婜娫1?14擔偱敪尰傪擣傔偨乮恾11乯丏Col2
mRNA偼丆惓忢泱偱偼丆st.22-28丆st.35丆st.41偺庡偲偟偰摢晹偵敪尰傪擣傔丆摿偵st.35偺摢晹偱嫮偔敪尰偟偰偄偨乮恾10乯丏Explant偱偼丆攟梴2擔偐傜敪尰偟偰偍傝丆攟梴4擔偱嵟傕嫮偔敪尰偟丆偦偺屻掅壓偟偨乮恾11乯丏Cart-1
mRNA 偼丆惓忢泱偱偼丆摢晹偵敪尰偼尷嬊偟偰偍傝丆st.22-28偺摢晹偱敪尰傪擣傔丆st.35傑偱偵忋徃偟丆偦偺屻st.41偱偼掅壓偟偨乮恾10乯丏Explant偱偼丆攟梴2擔偐傜敪尰傪擣傔丆4擔偱嵟傕敪尰偑忋徃偟丆偦偺屻掅壓偟偨乮恾11乯丏
gsc mRNA偼丆惓忢泱偱偼丆敪惗弶婜偺st.10偍傛傃丆st.35丆st.41偺摢晹偵尷嬊偟偰庛偄敪尰傪擣傔偨乮恾10乯丏Explant偱偼丆攟梴0擔偐傜敪尰傪擣傔丆3擔偱嵟傕敪尰偼忋徃偟丆偦傟埲崀掅壓偟偨乮恾11乯丏
ODC 偺敪尰偼偡傋偰偺惓忢泱丆explant偵敪尰傪擣傔丆攟梴婜娫傪捠偟偰敪尰検偼曄壔偟側偐偭偨乮恾10丆11乯丏
4. ISH偵傛傞奺堚揱巕偺嬊嵼偺専摙
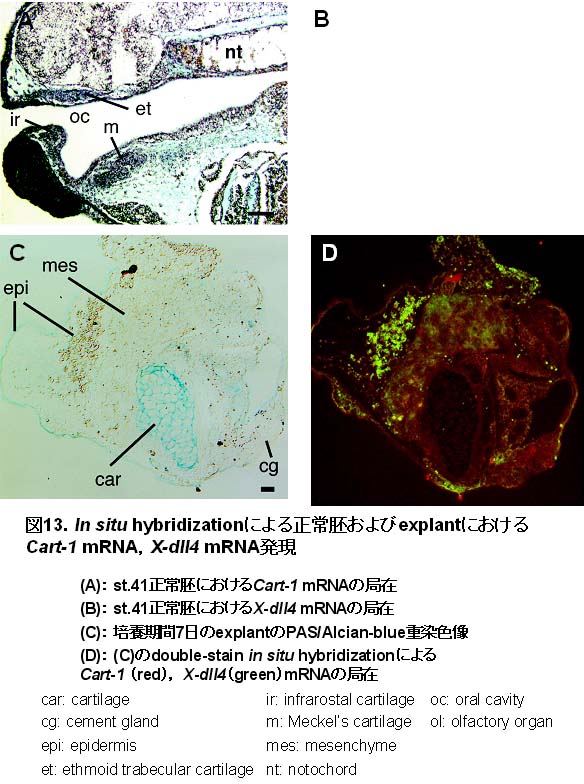
丂DIG昗幆Col2僾儘乕僽傪梡偄偰丆explant偍傛傃惓忢泱偵偍偗傞Col2 mRNA 偺嬊嵼傪ISH傪梡偄偰専摙偟偨丏偦偺寢壥丆st.42偺惓忢泱偱偼丆妠婄柺晹擃崪傗愐嶕慜曽晹偵敪尰傪擣傔偨乮恾12A丆B乯丏傑偨丆攟梴婜娫4擔偺explant偱偼丆枹惉弉擃崪嵶朎偵Col2
mRNA偺敪尰傪擣傔乮恾12C乯丆7擔偱偼丆擃崪嵶朎偵敪尰傪擣傔偨乮恾12D乯丏Cart-1
偍傛傃X-dll4 偺mRNA偺嬊嵼偼丆explant偱偼丆DIG昗幆Cart-1僾儘乕僽偲僼儖僆儗僙僀儞昗幆X-dll4僾儘乕僽偱擇廳愼怓偟偰偦偺嬊嵼傪専摙偟丆惓忢泱偱偼偦傟偧傟偺僾儘乕僽傪梡偄偰暿乆偵偦偺嬊嵼傪専摙偟偨丏偦偺寢壥丆st.41偺惓忢泱偱偼丆Cart-1
mRNA偼丆歬妎婍丆infrarostral擃崪丆岥奧曽崪丆儊僢働儖擃崪丆橐媩擃崪丆愐嶕偵敪尰傪擣傔乮恾13A乯丆X-dll4
mRNA偼丆歬妎婍丆僙儊儞僩態丆infrarostral擃崪丆ethmoidtrabecular擃崪丆堲摢忋旂偵嫮偔敪尰偟丆儊僢働儖擃崪偵庛偄敪尰傪擣傔偨乮恾13B乯丏Explant偱偼丆Cart-1
mRNA乮red乯偺庛偄敪尰傪擃崪嵶朎傗偦偺廃埻偺娫梩宯嵶朎偵擣傔偨乮恾13D乯丏堦曽丆X-dll4 mRNA乮green乯偺敪尰偼丆explant慡懱偵擣傔傜傟偨乮恾13D乯丏傑偨丆explant偵偍偗傞gsc
mRNA偺敪尰偵偼Cart-1丆X-dll4偺 ISH偱梡偄偨僒儞僾儖偲摨偠僒儞僾儖傪梡偄偰専摙偟偨丏偦偺寢壥丆gsc mRNA偺敪尰偼丆st.41偺惓忢泱偱偼丆infrarostral擃崪傗儊僢働儖擃崪偺枹惉弉擃崪嵶朎傗娫梩宯嵶朎嬅廤夠偵擣傔偨乮恾14A乯丏傑偨丆explant偱偼丆傾儖僔傾儞僽儖乕梲惈偺枹惉弉擃崪嵶朎傗偦偺廃埻偺娫梩宯嵶朎偵嫮偄敪尰傪擣傔偨乮恾14C乯丏
 |
戞4復丂峫嶡
丂崱傑偱偵椉惗椶泱偺AC偲傾僋僠價儞A傪梡偄偰in vitro偱庬乆偺憻婍傗婍姱偑宍惉偝傟傞偙偲偑柧傜偐偲側偭偰偒偰偄傞偑丆妠婄柺偺擃崪宍惉偵娭偟偰偼枹偩曬崘偝傟偰偄側偐偭偨丏
丂杮尋媶偵偍偄偰丆AC-SA偺攟梴婜娫傪廬棃偺4擔偐傜7擔偵墑挿偡傞偙偲偱丆傾儖僔傾儞僽儖乕梲惈擃崪尨婎傪桿摫偡傞偙偲偑偱偒偨丏偙傟偼丆惓忢泱偱偼擃崪宍惉偑庴惛屻4擔偱偼奐巒偝傟偰偍傜偢丆擃崪宍惉偑巒傑傞st.42偑庴惛屻5擔偵憡摉偡傞偨傔偵丆AC-SA偵偍偄偰傕廬棃偺4擔偺攟梴婜娫偱偼娫梩宯嵶朎偺嬅廤夠偼妋擣偝傟偨傕偺偺丆傾儖僔傾儞僽儖乕梲惈偺擃崪嵶朎傪妋擣偱偒側偐偭偨偲峫偊傜傟傞丏偦偺桿摫棪偵娭偟偰偼丆慜攟梴帪娫1帪娫偺忦審偱嵟傕崅偔47.8%偱偁偭偨丏傑偨丆慜攟梴帪娫傪偝傜偵墑挿偡傞偲丆娽曪丆僙儊儞僩態側偳偺慜曽摢晹慻怐偑桿摫偝傟傞孹岦偵偁偭偨丏偙傟傜偼丆AC-SA偵偍偄偰丆慜攟梴帪娫偵埶懚偟偰摢晹偐傜摲旜晹偺峔憿偑桿摫偝傟傞偙偲傪嵞妋擣偡傞傕偺偱偁傝丆慜攟梴帪娫1帪娫偱嵟傕崅棪偵妠婄柺偵憡摉偡傞晹埵傪桿摫偡傞堚揱巕敪尰偑惗偠丆偝傜偵慜攟梴帪娫傪墑挿偡傞偲丆傛傝慜曽摢晹慻怐傪桿摫偡傞堚揱巕敪尰偑惗偠傞偨傔偱偁傞偲峫偊傜傟傞丏
丂師偵丆擃崪暘壔偺摿挜揑側儅乕僇乕偱偁傞Col2偺explant偵偍偗傞敪尰傪柶塽慻怐妛揑偵専摙偟偨寢壥丆explant撪偱嵟弶偵枹暘壔娫梩宯嵶朎偑嬅廤夠傪宍惉偟丆偦偺屻丆Col2傪敪尰偡傞擃崪條嵶朎傗擃崪惈慻怐偑桿摫偝傟偨丏偝傜偵攟梴婜娫傪墑偽偡偲丆擃崪尨婎拞怱晹偺惉弉擃崪嵶朎偵偼Col2偺敪尰傪杦偳専弌偱偒側偔側傝丆擃崪尨婎廃埻偺擃崪枌條偺嵶朎偺傒偵偦偺敪尰傪尷嬊偟偰擣傔偨丏堦曽丆惓忢泱偵偍偗傞Col2偺敪尰僷僞乕儞傕explant偲堦抳偟偨乮枹宖嵹僨乕僞乯丏傑偨丆explant偵偍偗傞RT-PCR偵傛傞夝愅偵偍偄偰傕Col2
mRNA偺敪尰偼丆攟梴婜娫4乣7擔偱敪尰検偑忋徃偟丆10擔偐傜尭彮偟偨偙偲偐傜丆explant偵偍偗傞擃崪宍惉偑惓忢泱偲摨條側暘壔條幃傪偲傝丆explant偵偍偄偰傕擃崪嵶朎偑旍戝擃崪偺忬懺傑偱暘壔偟偨偲峫偊傜傟偨丏
丂儂儊僆僪儊僀儞傪娷傓堚揱巕偱偁傞Cart-1偼丆儅僂僗傗儔僢僩偺戀惗婜偺敪堢偵偍偄偰丆彨棃擃崪宍惉偑惗偠傞摢晹拞泱梩丆懁曽拞泱梩偍傛傃巿夊偵嫮偔敪尰偟丆偦偺敪尰偼丆擃崪宍惉弶婜偺慜嬱擃崪嵶朎偺嬅廤夠傗擃崪嵶朎偵嫮偔丆惉弉擃崪偱偼丆敪尰偑掅壓偡傞丏偝傜偵丆摨堚揱巕偺僲僢僋傾僂僩儅僂僗偱偼丆摢奧姤偺寚懝傗忋壓妠丆杍崪偺徕彫壔傪帵偡偙偲偐傜丆儅僂僗傗儔僢僩偵偍偄偰丆Cart-1偼擃崪暘壔偵廳梫側栶妱傪扴偆堚揱巕偱偁傞偲峫偊傜傟偰偄傞偑丆Xenopus偵偍偗傞Cart-1偺敪尰帪婜傗敪尰晹埵摍偵娭偡傞曬崘偼側偐偭偨丏杮尋媶偱丆惓忢泱偺RT-PCR偵偍偄偰Cart-1
mRNA偺敪尰偑摢晹偵尷嬊偟偰偍傝丆傑偨丆ISH偵偍偄偰傕偦偺敪尰傪妠婄柺擃崪傗偦偺廃埻偺娫梩宯嵶朎丆愐嶕慜曽晹偵尷嬊偟偰擣傔偨偙偲偼丆儔僢僩傗儅僂僗偵偍偗傞寢壥偲堦抳偟偰偄傞偲峫偊傜傟傞丏偝傜偵丆explant偱偼丆Cart-1偺敪尰偼攟梴婜娫4擔偱僺乕僋傪帵偟偨丏偙傟偼丆嬅廤夠傪宍惉偡傞娫梩宯嵶朎偑擃崪嵶朎傊偺暘壔傪奐巒偡傞帪婜偵憡摉偟丆儔僢僩偵偍偗傞擃崪宍惉弶婜偵敪尰検偑忋徃偡傞偲偄偆曬崘偲堦抳偡傞丏傑偨丆ISH偵偍偄偰傕偦偺敪尰傪擃崪尨婎偲廃埻偺娫梩宯嵶朎偵擣傔偨丏廬偭偰丆Xenopus偵偍偄偰傕陽帟椶偲摨條偵Cart-1偼娫梩宯嵶朎偑擃崪嵶朎偵暘壔偡傞嵺偵摥偒丆explant偱傕擃崪偵暘壔偡傞嵺偺僇僗働乕僪偑婡擻偟偰偄傞偲峫偊傜傟傞丏
丂儂儊僆儃僢僋僗堚揱巕偱偁傞X-dll4偼丆僔儑僂僕儑僂僶僄偺Distal-less偺儂儌儘僌偱偁傞丏惓忢泱偵偍偄偰丆X-dll4偼丆慜曽奜泱梩桼棃慻怐丆偡側傢偪慜擼暊懁丆橐媩擃崪丆摢奧晹恄宱採嵶朎丆僙儊儞僩態偵敪尰偟偰偄傞丏傑偨丆X-dll4偺儅僂僗偺儂儌儘僌偱偁傞Distal-less
2乮Dlx-2乯偼丆慜擼丆壓妠丆忋妠尨婎丆帟傠朎傗岥峯忋旂側偳偵敪尰偟偰偍傝丆Dlx-2偺僲僢僋傾僂僩儅僂僗偼壓妠崪媩丆愩崪媩桼棃偺摢晹崪奿偺寚懝傪帵偡丏偙傟傜傛傝X-dll4偼妠婄柺椞堟偺敪堢偵偍偄偰廳梫側堚揱巕偱偁傞偲峫偊傜傟偰偄傞丏杮尋媶偵偰丆惓忢泱偱偼丆奺僗僥乕僕偺摢晹椞堟偵X-dll4偺敪尰傪擣傔偨偑丆摲旜晹偵偼敪尰傪擣傔側偐偭偨丏傑偨丆ISH偱偼丆歬妎婍丆僙儊儞僩態丆堲摢忋旂丆暊懁擃崪偵敪尰傪擣傔偨丏傑偨丆explant偱偼丆RT-PCR偱敪尰傪擣傔丆ISH偱偼丆explant慡懱偵敪尰傪擣傔偨丏偙傟傜傛傝丆explant撪晹偵桿摫偝傟偨慻怐傗婍姱偑丆惓忢泱偵偍偗傞摢晹椞堟偵憡摉偡傞傕偺偱偁傞偙偲傪帵偟偰偄傞偲峫偊傜傟傞丏
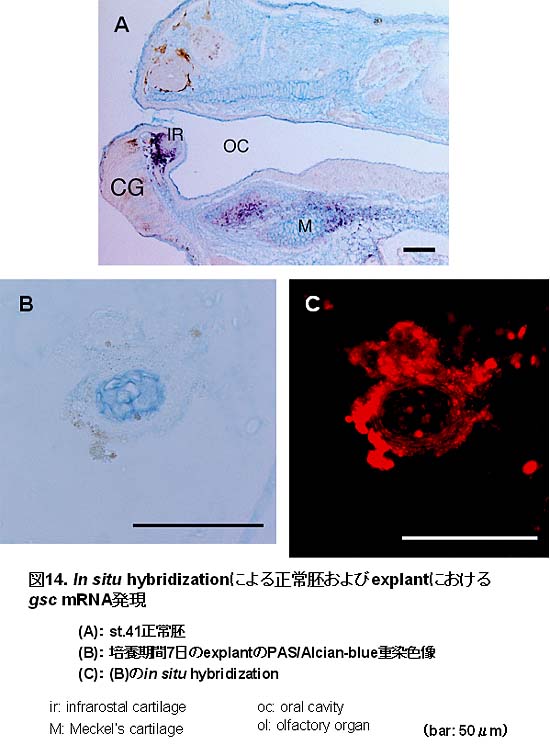
丂儂儊僆儃僢僋僗堚揱巕偱偁傞gsc偼丆拞泱梩桿摫偺娫偵傾僋僠價儞A偵傛偭偰捈愙妶惈壔偝傟傞丏傑偨丆gsc偼丆旜夎婜偺Xenopus偺梒惗偱偼丆摢晹暊懁偵尷嬊偟偰敪尰偡傞丏傑偨丆儅僂僗偺戀惗屻婜偱偼丆摢晹丆巿夊側偳偵敪尰偡傞丏偝傜偵gsc偺僲僢僋傾僂僩儅僂僗偼丆旲峯丆撪帹偺堎忢傗壓妠崪偺敪堢晄慡丆壓妠崪廃埻偍傛傃愩偺嬝擏偺宍惉晄慡傗敪堢晄慡傪帵偡偙偲偐傜丆gsc偼妠婄柺椞堟偺宍惉偵廳梫側堚揱巕偱偁傞偲峫偊傜傟偰偄傞丏杮尋媶偱丆ISH偺寢壥丆st.41偺Xenopus偺梒惗偵偍偄偰丆壓妠晹偺infrarostral擃崪偍傛傃儊僢働儖擃崪偵尷嬊偟偰gsc
mRNA偺敪尰傪擣傔丆傑偨explant偱偼丆擃崪尨婎偲偦偺廃埻偺娫梩宯嵶朎偵偦偺敪尰傪擣傔偨丏偟偨偑偭偰丆explant撪偵摢晹暊懁拞泱梩偑桿摫偝傟丆娫梩宯嵶朎偑壓妠晹傪娷傓妠婄柺擃崪偵憡摉偡傞晹埵偺擃崪偵暘壔偟偨偲峫偊傜傟傞丏
戞5復丂寢岅
丂崱夞丆Xenopus泱偺AC偲傾僋僠價儞A傪梡偄偰丆慜曽暊懁娫梩宯嵶朎偵桼棃偡傞壓妠晹偵憡摉偡傞偲峫偊傜傟傞擃崪傪in vitro偵偰桿摫偡傞偙偲偑偱偒偨丏杮傾僢僙僀宯偼丆儅僂僗ES嵶朎偐傜擃崪傪桿摫偡傞宯傗丆僸僩偺崪悜嵶朎桼棃偺娫梩宯姴嵶朎偐傜擃崪嵶朎傪桿摫偡傞宯側偳偲偼堎側傝丆嵶朎暘壔偩偗偱偼側偔丆敪惗偵偍偗傞僷僞乕儞宍惉傪傕嵞尰偟丆妠婄柺椞堟偵憡摉偡傞偲巚傢傟傞擃崪丆偝傜偵偼帟夊傪傕慖戰揑偵桿摫偱偒傞偲峫偊傜傟傞丏偟偨偑偭偰丆杮宯傪梡偄傞偙偲偵傛傝崱屻丆偙傟傑偱偲偼堘偭偨奣擮偺嵞惗堛椕傪揥奐偱偒傞偲峫偊傜傟傞丏
杮尋媶偺堦晹偼Proc. Natl. Acad. Sci. U S A vol.99 No.24:15474-15479, 2002.
Furue et al.偵敪昞偟偨.
|
